| Sulfato de magnésio | |
|---|---|
 | |
| Nome IUPAC | Sulfato de magnésio |
| Outros nomes | Sal de Epsom Sal amargo |
| Identificadores | |
| Número CAS | , 14168-73-1 (monohydrate) 24378-31-2 (tetrahydrate) 15553-21-6 (pentahydrate) 13778-97-7 (hexahydrate) 10034-99-8 (heptahydrate) |
| PubChem | |
| Número RTECS | OM4500000 |
| Propriedades | |
| Fórmula molecular | MgSO4 |
| Massa molar | 120.415 g/mol (anhydrous) 246.47 g/mol (heptahydrate) |
| Aparência | sólido cristalino branco |
| Densidade | 2.66 g/cm3 (anhydrous) 2.445 g/cm3 (monohydrate) 1.68 g/cm3 (heptahydrate) |
| Ponto de fusão | 1124 °C (anhydrous, decomp) |
| Solubilidade em água | anhydrous 26.9 g/100 mL (0 °C) 25.5 g/100 mL (20 °C) heptahydrate 71 g/100 mL (20 °C) |
| Solubilidade | .0116 g/100 mL (18 °C, ether) slightly soluble in alcohol, glycerol insoluble in acetone |
| Índice de refracção (nD) | 1.523 (monohydrate) 1.433 (heptahydrate) |
| Estrutura | |
| Estrutura cristalina | monoclinic (hydrate) |
| Riscos associados | |
| MSDS | External MSDS |
| Índice UE | Not listed |
| Compostos relacionados | |
| Outros aniões/ânions | Sulfeto de magnésio Sulfito de magnésio Perclorato de magnésio Fosfato de magnésio |
| Outros catiões/cátions | Sulfato de berílio Sulfato de cálcio Sulfato de estrôncio Sulfato de bário Sulfato de sódio Sulfato de alumínio |
| Excepto onde denotado, os dados referem-se a materiais sob condições PTN Referências e avisos gerais sobre esta caixa | |
O sulfato de magnésio ou sulfato magnésico, de nome comum sal de Epsom, é um composto químico que contém magnésio, e cuja fórmula é MgSO4·7H2O. O sulfato de magnésio sem hidratar-se (anidro) MgSO4 é muito pouco frequente e se emprega na indústria como agente secante.
Índice[esconder] |
[editar] Origem histórica
O sal de Epsom foi elaborado originalmante mediante cozimento das águas minerais da comarca próxima a Epsom, Inglaterra, e logo preparados a partir da água do mar. Em tempos posteriores os sais foram obtidos de um mineral denominado epsomita.
[editar] Obtenção
O sulfato de magnésio pode ser obtido a partir de magnésio e ácido sulfúrico, segundo a seguinte reação:
Também partindo dos óxidos de magnésio ou de seus hidróxidos, mais ácido sulfúrico:
[editar] Usos
[editar] Uso agrário
Em agricultura e jardinagem o sulfato de magnésio é empregado como corretor da deficiência de magnésio no solo (o magnésio é um elemento essencial no processo da molécula de clorofila). É comum sua aplicação no cultivo de plantas em pomares ou vasos quando seus solos carecem de suficiente magnésio, por exemplo para batatas, rosas, e tomates. A vantagem do sulfato de magnésio sobre outros aditivos de magnésio para o solo, é sua alta solubilidade.
É usado, exatamente porque nutriente para a vida vegetal, nas soluções destinadas ao cultivo por hidroponia
[editar] Uso médico
Em uso local pode utilizar-se para o tratamento da unha encravada. O sulfato de magnésio oral e o hidróxido de magnésio se empregam como laxante para as grávidas. Os sais de Epsom também estão disponíveis na forma de gel para aplicação tópica sobre feridas e áreas doloridas. Em administração intravenosa se emprega frequentemente para reduzir a intensidade das cãimbras. Por outro lado é utilizado durante a gravidez para a prevenção das crises convulsivas ou em coma conhecidos como Eclampsia. Além disso pode ser utilizado como broncodilatador - logo de que as drogas betaagonistas e anticolinérgicas tenham produzido uma desensibilização de seus respectivos receptores - nas exacerbações severas da asma. Também pode ser empregado na forma de nebulizações para aliviar os sintomas da asma, ou subministrá-lo em via intravenosa para tratar casos de crises asmáticas severas.
[editar] Outros usos
O sulfato de magnésio é empregado além disso como sais de banho, particularmente na terapia de flutuação, porque altas concentrações deste sal dissolvido em água aumentam a densidade da solução, o que faz que um corpo humano flutue como uma bóia. Tradicionalmente tem-se empregado para preparar banhos para os pés com propósitos de relaxamento. Em algumas partes do mundo (como na Nova Zelândia) é adicionado às bebidas caseiras; neste caso o radical sulfato não é importante, porque é o magnésio o que proporciona um sabor entre ácido e amargo, devido a seu íon Mg2+ que atua como saborizante.
O sulfato de magnésio se classifica e prepara com diversos graus de pureza, de acordo com seus distintos usos. Não deve confundir-se o grau agrícola, utilizado no campo, armazenado junto a pesticidas e outros produtos agrários, com o grau alimentício ou o farmacêutico, os que devem cumprir com as distintas normas do grau de pureza exigido.

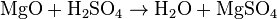



Nenhum comentário:
Postar um comentário